
Der pH-Wert
Jede wässrige Lösung hat einen pH-Wert, wobei verschiedene Bestandteile der Lösungen dazu führen, dass sie nicht – wie reines Wasser – neutral, sondern mehr oder weniger sauer oder alkalisch reagieren. Zellen und Gewebe, grundsätzlich alle Lebewesen, regulieren die pH-Werte ihrer inneren Milieus kontinuierlich auf bestimmte Sollwertbereiche. Beispielsweise arbeiten in unserem Magen (pH-Wert um 2) und Darm (pH-Wert um 8,5) Verdauungsenzyme mit verschiedenen pH-Wert-Optima. Doch was genau ist eigentlich der pH-Wert?
Ein Molekül, welches ein positiv geladenes Wasserstoff-Ion (H![]() ) abgeben kann, wird in der Chemie als Säure bezeichnet. Umgekehrt kann eine Base ein H
) abgeben kann, wird in der Chemie als Säure bezeichnet. Umgekehrt kann eine Base ein H![]() -Ion aufnehmen. Wie sauer oder wie basisch eine Lösung ist, lässt sich über den pH-Wert bestimmen. Der pH-Wert gibt an, wie hoch die Konzentration von H
-Ion aufnehmen. Wie sauer oder wie basisch eine Lösung ist, lässt sich über den pH-Wert bestimmen. Der pH-Wert gibt an, wie hoch die Konzentration von H![]() -Ionen des betreffenden Stoffes in wässriger Lösung ist. Dies hängt natürlich auch etwas davon ab, wie stark der betreffende Stoff dissoziiert (zerfällt) und somit die Ionen an die Umgebung abgibt. Je höher die Konzentration der freigesetzten H
-Ionen des betreffenden Stoffes in wässriger Lösung ist. Dies hängt natürlich auch etwas davon ab, wie stark der betreffende Stoff dissoziiert (zerfällt) und somit die Ionen an die Umgebung abgibt. Je höher die Konzentration der freigesetzten H![]() -Ionen, desto saurer die Lösung und desto kleiner der pH-Wert. Bei einem pH-Wert von 7 ist die Lösung neutral, darüber basisch (auch alkalisch genannt). Die pH-Wert Skala reicht von 1–14.
-Ionen, desto saurer die Lösung und desto kleiner der pH-Wert. Bei einem pH-Wert von 7 ist die Lösung neutral, darüber basisch (auch alkalisch genannt). Die pH-Wert Skala reicht von 1–14.
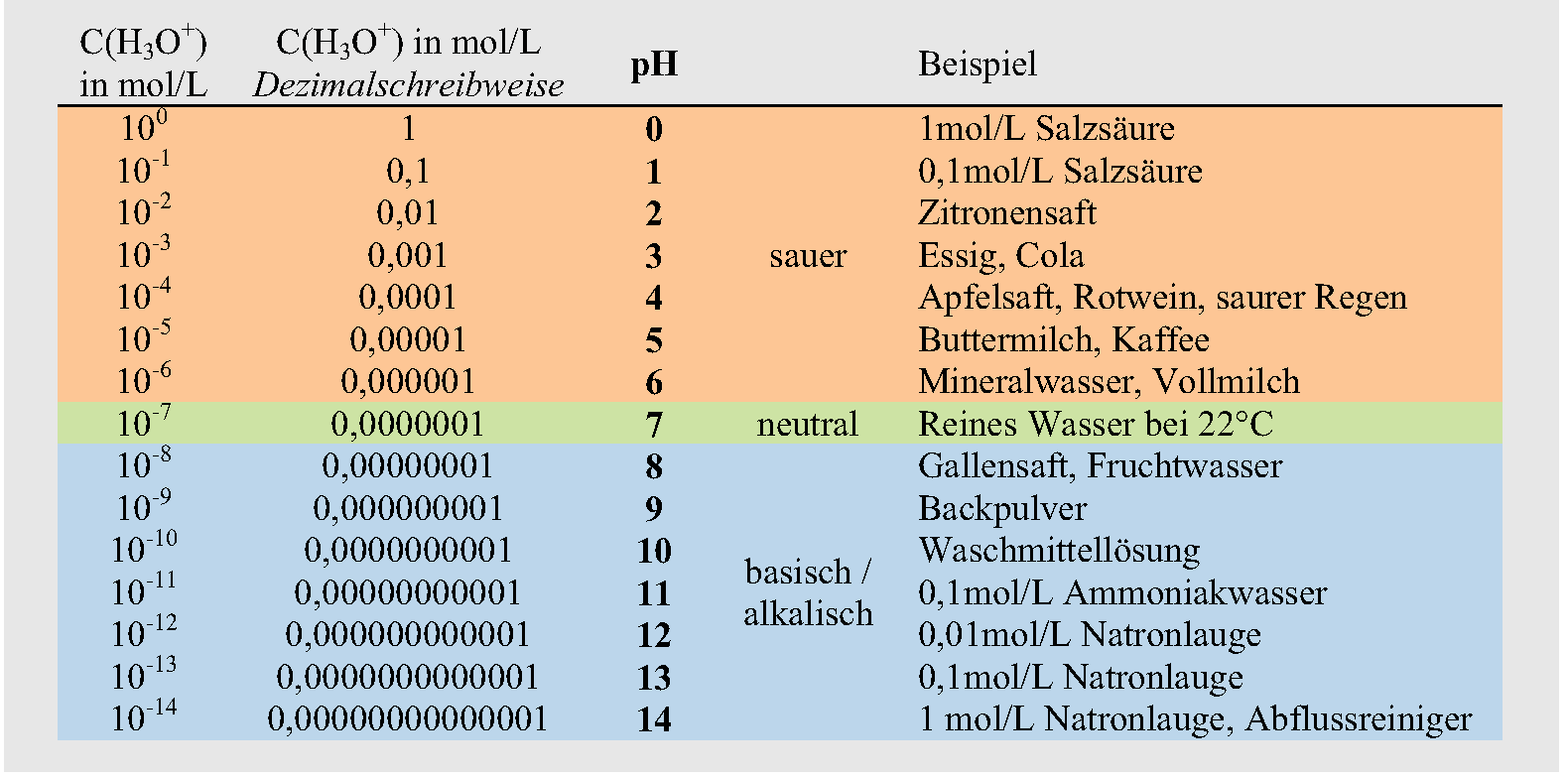
Da die Konzentration der H![]() -Ionen von 1mol/L bis zu 0,00000000000001 mol/L schwanken kann, gibt man sie nicht direkt an. Rechnerisch wird der pH-Wert deshalb als „der negative dekadische Logarithmus der molaren Wasserstoffionen-Konzentration“ festgelegt. Klingt zunächst kompliziert, ist aber recht logisch. Das Rechnen mit dem Logarithmus erleichtert das Rechnen mit vielstelligen Zahlen. Überlegen Sie doch einfach mal, Sie müssten eine Skala von 10
-Ionen von 1mol/L bis zu 0,00000000000001 mol/L schwanken kann, gibt man sie nicht direkt an. Rechnerisch wird der pH-Wert deshalb als „der negative dekadische Logarithmus der molaren Wasserstoffionen-Konzentration“ festgelegt. Klingt zunächst kompliziert, ist aber recht logisch. Das Rechnen mit dem Logarithmus erleichtert das Rechnen mit vielstelligen Zahlen. Überlegen Sie doch einfach mal, Sie müssten eine Skala von 10![]() (entspricht der Dezimalzahl 0,1) bis zu
(entspricht der Dezimalzahl 0,1) bis zu ![]() (0,00000000000001; also 14 Stellen nach dem Komma) zeichnen. Dies wäre eine recht umständliche Angelegenheit. Der „dekadische“ Logarithmus ist der Logarithmus zur Basis 10; auch Zehnerlogarithmus genannt. „Negativ“ dreht nur das Vorzeichen um. Einfacher ausgedrückt: Schreibt man die Konzentration der Wasserstoff-Ionen als Zehnerpotenz c (H
(0,00000000000001; also 14 Stellen nach dem Komma) zeichnen. Dies wäre eine recht umständliche Angelegenheit. Der „dekadische“ Logarithmus ist der Logarithmus zur Basis 10; auch Zehnerlogarithmus genannt. „Negativ“ dreht nur das Vorzeichen um. Einfacher ausgedrückt: Schreibt man die Konzentration der Wasserstoff-Ionen als Zehnerpotenz c (H![]() in mol/L, so ist der pH-Wertgerade
in mol/L, so ist der pH-Wertgerade ![]() . Haben wir die Zahl
. Haben wir die Zahl ![]() , ist der negative dekadische Logarithmus = 7. Durch diese Berechnung vereinfacht sich also die Skala und man verwendet nur Zahlen von 1 bis 14. Sinkt der pH-Wert einer Lösung um eine Einheit, bedeutet dies aufgrund der logarithmischen Skala, dass sich die H
, ist der negative dekadische Logarithmus = 7. Durch diese Berechnung vereinfacht sich also die Skala und man verwendet nur Zahlen von 1 bis 14. Sinkt der pH-Wert einer Lösung um eine Einheit, bedeutet dies aufgrund der logarithmischen Skala, dass sich die H![]() -Ionen Konzentration um den Faktor 10 erhöht hat. Oder wussten Sie bereits, dass eine Flüssigkeit mit pH 3 die zehnfache Menge an H
-Ionen Konzentration um den Faktor 10 erhöht hat. Oder wussten Sie bereits, dass eine Flüssigkeit mit pH 3 die zehnfache Menge an H![]() -Ionen enthält wie eine Flüssigkeit mit pH 4 und die 100fache Menge an H
-Ionen enthält wie eine Flüssigkeit mit pH 4 und die 100fache Menge an H![]() -Ionen wie eine Flüssigkeit mit pH 5? Bei einem pH-Wert von 3 beträgt das Verhältnis von Wassermolekülen zu freien H
-Ionen wie eine Flüssigkeit mit pH 5? Bei einem pH-Wert von 3 beträgt das Verhältnis von Wassermolekülen zu freien H![]() -Ionen 1000:1 (also 103). Bei einem pH-Wert von 4 beträgt dieses Verhältnis 10.000:1, also 104.
-Ionen 1000:1 (also 103). Bei einem pH-Wert von 4 beträgt dieses Verhältnis 10.000:1, also 104.
Wie bestimmt man den pH-Wert?
Zur Bestimmung des pH-Wertes gibt es neben der Berechnung verschiedene Möglichkeiten. Einen kleinen Hinweis, ob eine wässrige Lösung sauer oder alkalisch sein könnte, könnte der Geschmack geben. Dies funktioniert aber nicht immer, denn beispielsweise bei dem Vergleich von Essig und Cola, die beide jeweils einen pH-Wert von circa 3 haben, schmeckt Essig eindeutig nach Säure, Cola aber nicht. Da die Geschmacksprobe im Labor also erstens ungenau und zweitens viel zu gefährlich wäre, erfasst man den pH-Wert mittels Indikatoren oder digitaler Messgeräte. Indikatoren sind Farbstoffe, welche in einem bestimmten pH-Bereich ihre Farbe verändern. Ein bekannter Indikator ist beispielsweise der Lackmusfarbstoff, der sich in sauren Lösungen rot und in basischen Lösungen blau färbt. In der Praxis werden entweder mit Indikatoren getränkte Papierstreifen – so genannte Indikatorpapiere – verwendet oder Mischungen verschiedener Indikatorlösungen, deren Umschlagsbereiche so gewählt werden, dass bei jedem pH-Wert eine andere Farbe auftritt (Universalindikatoren). Dabei ist die Verwendung von Teststreifen oder Indikatorpapieren die ungenauere Variante und dient bestenfalls zur Abschätzung des pH-Wertes. Eine schnelle und korrekte Ermittlung wird mittels digitaler Geräte erreicht.
1] B. P. Kremer, H. Bannwarth, Einführung in die Laborpraxis, SpringerVerlag Berlin Heidelberg, 2009.
Interesse an mehr?




