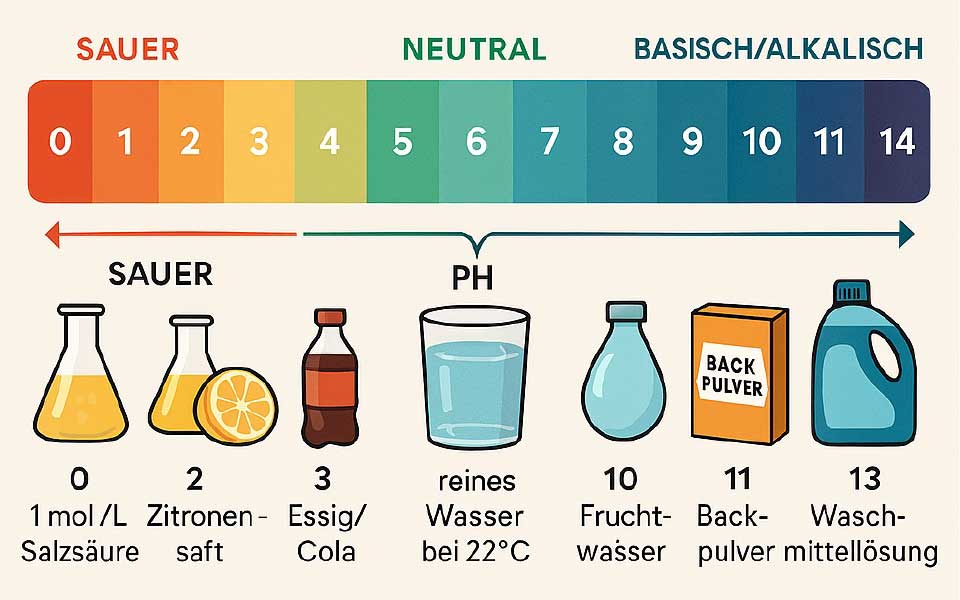
Der pH-Wert sagt uns, wie sauer oder basisch (alkalisch) eine Lösung ist. Die Skala reicht von 0 bis 14:
- pH 7 ist neutral (z. B. reines Wasser),
- unter 7 ist sauer (z. B. Zitronensaft),
- über 7 ist basisch (z. B. Seifenlauge).
Der Begriff „pH“ steht für „potentia hydrogenii“ (so die Legende…), also die „Kraft des Wasserstoffs“. Genauer gesagt: Wie viele Wasserstoffionen (H⁺) in einer Lösung herumschwirren. Je mehr davon, desto saurer ist die Lösung – und desto kleiner der pH-Wert.
Weil diese Konzentrationen winzig klein sein können (z. B. 0,00000000000001 mol/L), rechnet man lieber mit dem negativen Zehnerlogarithmus. Klingt kompliziert, heißt aber nur: Statt mit vielen Nullen zu hantieren, nutzt man eine handliche Skala von 0 bis 14.
Warum müssen Chemie-Studierende das wissen?
Ganz einfach: Der pH-Wert ist überall.
- In der Biochemie: Enzyme funktionieren nur bei bestimmten pH-Werten. Im Magen z. B. bei etwa 2, im Dünndarm eher bei 8,5.
- In der Analytik: Viele Nachweisreaktionen hängen vom pH-Wert ab – zu sauer oder zu basisch, und der Test schlägt fehl.
- In der Synthese: Manche Reaktionen laufen nur in einem bestimmten pH-Bereich ab. Wer das ignoriert, bekommt statt Produkt nur Pampe.
- In der Umweltchemie: Der pH-Wert von Böden oder Gewässern entscheidet über das Leben darin – oder ob Fische sterben.
Kurz: Der pH-Wert ist wie ein Stimmungsbarometer für chemische Systeme. Wer ihn versteht, kann besser vorhersagen, was passiert – und warum.
Auch interessant:



